欧测与行业的最新动态
MDR欧盟医疗器械数据库的SRN如何注册
医疗器械指令MDD(93/42/EEC)和有源植入类医疗器械指令AIMDD(90/385/EEC)被医疗器械法规MDR(EU 2017/745)取代,法规过渡期为3年。也即2020年5月6日将正式取代MDD和AIMDD.新法规将取代现行的三个医疗器械指令:分别是医疗器械指令93/42/EEC,有源医疗器械指令90/385/EEC及体外诊断医疗器械指令98/79/EEC。
MDR强制性实施时间:2020年5月26日
因2020年的疫情原因,MDR法规推迟一年执行,即2021年5月26日执行,MDR执行以来,我们中国的制造商还好吗?

MDR执行对中国制造商直接的影响:
- 提出EUDAMED数据库的建立和使用
- 提出经济运营商需要注册SRN
- 提出器械的可追溯性(UDI)
- 技术文件要求变多
- 需要对器械上市后的监督作出计划
- 临床评价相关要求变的严格
对于有意销往欧盟的中国制造商需要在取证前申请SRN,SRN(唯一注册码)全称是Single Registration Number,是每个经济运营商在EUDAMED以及相关官方文件和报告上的唯一身份标识。
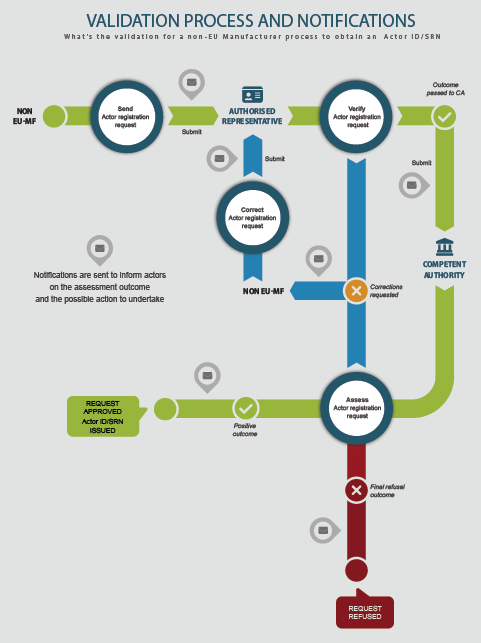
非欧盟制造商SRN注册流程
- 当非欧盟制造商提交其经济运营商注册请求时,其选定的授权代表在将注册请求传递给国家主管当局进行评估之前对其进行验证。
- 负责授权代表的国家主管当局在批准注册请求后颁发经济运营商ID/SRN(由EUDAMED生成)。
- EUDAMED通过电子邮件通知经济运营商ID/SRN给非欧盟制造商。
申请SRN需要递交什么资料
- 欧洲医疗设备数据库信息安全责任宣言Declaration on information security responsibilities in the context of the European medical device database
- 针对欧盟境外制造商授权的声明 EUDAMED Mandate summary document that a non-EU manufacturer should provided in its Actor registration request

OUCE欧测提供安全并可持续发展的解决方案,是您值得信赖的合作伙伴。作为独立、公正和专业的机构,我们长期致力于为合作伙伴及客户切实地增添价值。
![]() ©2025 OUCE欧测 保留所有权利 沪ICP备2022033013号-1
©2025 OUCE欧测 保留所有权利 沪ICP备2022033013号-1  沪公网安备 31010602006396号
沪公网安备 31010602006396号











